Sais
O sal comum, NaCl está presente em nossa alimentação, na conservação de alimentos, o bicardonato de sódio, NaHCO3, é usado comop antiácido e também no preparo de bolos e biscoitos. Sal é toda substância que em água produz um cátion diferente do H+ e um ânion diferente do OH-.
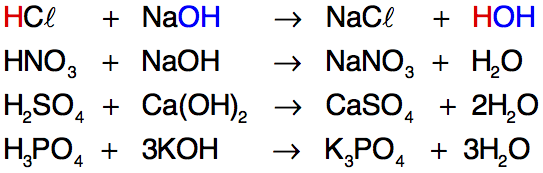
Os sais são formados a partir da reação de um ácido com uma base, que é a reação de neutralização, formando também água.
HCl + NaOH → NaCl + H2O Os sais são formados a partir da reação de um ácido com uma base, que é a reação de neutralização, formando também água.
1. Características
- conduzem eletricidade quando estão na fase líquida (fundidos) ou em solução aquosa, porque nestes casos há elétrons livres;
- geralmente são sólidos à temperatura e pressão ambiente (25°C e 1atm).
2. Neutralização
A neutralização faz com que os íons H+ e OH– presentes em solução se transformem em água e, dessa forma, apenas os outros íons provenientes do ácido e da base permaneçam em solução. ácido + base → sal + água Exemplo:
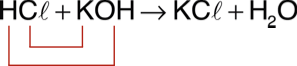
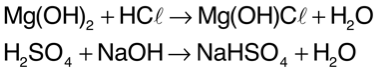
3. Nomenclatura
Os sais derivam da reação de um ácido ou óxido com uma base.
Os sais sem oxigênio mudam a terminação IDRICO para a terminação ETO. Exemplo:
- CaS – sulfeto de cálcio, vem do ácido sulfídrico
- RbH – fluoreto de rubídio, vem do ácido fluorídrico
- Na2SO3 – sulfito de sódio, vem do ácido sulfuroso
- LiNO2 – nitrito de lítio, vem do ácido nitroso
- Na2SO4 – sulfato de sódio, vem do ácido sulfúrico
- NaClO3 – clorato de sódio, vem do ácido clórico.
- NaPO3 – metafosfato de sódio, vem do ácido metafosfórico
- Ca2P2O7 – pirofosfato de cálcio, vem do ácido pirofosfórico.
A única diferença dos sais normais é que indicaremos a quantidade de hidrogênios ionizáveis por meio dos prefixos mono-hidrogeno (o mono pode ser omitido), di-hidrogeno etc.
NaH2PO4 – di-hidrogeno-fosfato de sódio
Na2HPO4 – (mono-)hidrogeno-fosfato de sódio
NaHSO4 – (mono-)hidrogeno-sulfato de sódio
NaHCO3 – (mono-)hidrogeno-carbonato de sódio
NaH2PO4 – di-hidrogeno-fosfato de sódio
Na2HPO4 – (mono-)hidrogeno-fosfato de sódio
NaHSO4 – (mono-)hidrogeno-sulfato de sódio
NaHCO3 – (mono-)hidrogeno-carbonato de sódio
Os hidrogenos-sais eram antigamente chamados de sais ácidos. Assim,
outra opção para dar nome a esses sais é utilizar-se dos termos
monoácido, diácido etc.
NaH2PO4 – fosfato diácido de sódio
NaHSO4 – sulfato (mono)ácido de sódio
NaHSO4 – sulfato (mono)ácido de sódio
Quando o hidrogeno-sal for originário de um ácido com dois hidrogênios
ionizáveis (e somente nesses casos), pode-se substituir o prefixo
mono-hidrogeno por bi. Nesse contexto, o prefixo Bi não tem o
significado de “dois”.
NaHSO4 – bisulfato de sódio
NaHCO3 – bicarbonato de sódio
NaHSO4 – bisulfato de sódio
NaHCO3 – bicarbonato de sódio
Nomenclatura semelhante a dos hidrogenia-sais.
Al(OH)2Cl – di-hidroxi-cloreto de alumínio
Al(OH)Cl2 – (mono-)hidróxi-cloreto de alumínio
Ca(OH)NO3 – (mono-)hidroxi-nitrato de cálcio
Al(OH)2Cl – di-hidroxi-cloreto de alumínio
Al(OH)Cl2 – (mono-)hidróxi-cloreto de alumínio
Ca(OH)NO3 – (mono-)hidroxi-nitrato de cálcio
Ou ainda, de acordo com uma nomenclatura antiga
Al(OH)2Cl – cloreto dibásico de alumínio
Al(OH)Cl2 – cloreto (mono)básico de alumínio
Ca(OH)NO3 – nitrato (mono)básico de cálcio
Al(OH)Cl2 – cloreto (mono)básico de alumínio
Ca(OH)NO3 – nitrato (mono)básico de cálcio
Nenhum comentário:
Postar um comentário