1. Algarismo significativos:
- Zero a esquerda não conta como algarismo significativo, exemplo:
0078: 2 algarismos siginificativos
87,08: 4 algarismos siginificativos
2. Ordem de grandeza:
Para saber a ordem de grandeza de um número é necessário fazer a notação científica, para deixar o n menor que 10
Ex: 8000097, notação científica: 8,000097 x 10 elevado a 6°
ordem de grandeza: 10 elevado a 7°
A ordem de grandeza virou 10 elevado a 7° pois o número oito é maior que 3,16 ou raiz de 10, ou seja, na ordem de grandeza quando o número for maior que 3,16 a potência do 10 aumenta um número.
3. Vm=Variação de espaço (delta S)/Variação de tempo (delta T)
4. MRU: Esse movimento tem apenas uma fórmula: S=So+V.T Ele tem apenas dois movimentos: Progressivo: v+
Retrógrado: v-
O gráfico desse movimento é sempre uma RETA.
5. MRUV: A diferença entre esse movimento e o uniforme é que a velocidade varia com o tempo pois na partícula existe uma aceleração constante. O gráfico desse movimento é uma PARÁBOLA.
Fórmulas: S=So+Vo.T+a.t²/2
V=Vo+a.T
V²=Vo²=2.a.Delta S
Os movimentos são:
Acelerado: a+
Retardado: a-
"Eu creio no Cristianismo tal como creio que o Sol nasceu, não apenas porque o vejo mas porque através dele eu vejo todas as outras coisas." C.S.Lewis
quarta-feira, 26 de março de 2014
terça-feira, 25 de março de 2014
Literatura
O
que é literartura?
Os textos literários são aqueles que apresentam preocupação com a forma de passar a mensaguem ao leitor, essa característica é denominada de estética.
A
diferença mais conhecida e primordial entre o texto não-literário
e o literário é que o não-literário não se preocupa com a função
poética, apenas transmite um fato, já o texto literário se
preocupa com a função poética.Os textos literários são aqueles que apresentam preocupação com a forma de passar a mensaguem ao leitor, essa característica é denominada de estética.
Um exemplo de texto literário é o poema de Camões (que esta nos slides), Camões poderia simplesmente organizar uma dissrtação ou um texto argumentativo para falar sobre o amor, utilizando citações e outras coisa, mas não ele faz uma poesia que descreve o amor.
Função
da linguagem:
1)
Função Referencial ou denotativa
Se
preocupa em trasmitir uma informação objetiva, ela prioriza o
referente, ou seja, o assunto ao qual a mensagem se refere.
Exemplo:
Numa
cesta de vime temos um cacho de uvas, uma maçã, uma laranja,
uma banana e um morango. (Este texto informa
o que há dentro da cesta, logo, há função referencial).
|
2)
Função Expressiva ou Emotiva
Reflete
as emoções do emissor, uma caraterística é alguns sinais de
pontuação, como as reticências e o ponto de exclamação.
Exemplos:
Nós
te amamos!
|
3)
Função Apelativa ou Conativa
Seu
objetivo é influenciar o receptor. Como o emissor se dirige ao
receptor, é comum o uso de tu e você, ou o nome da pessoa, além
dos vocativos e imperativo.
Exemplos:
Não
perca esta promoção!
4)
Função Poética
É
a função que se preocupa mais em como dizer do que com o
que dizer. Embora seja própria da obra literária, a
função poética não é exclusiva da poesia nem da literatura em
geral, pois se encontra com frequência nas expressões cotidianas de
valor metafórico e na publicidade.
Exemplos:
Em
tempos de turbulência, voe com fundos de renda fixa.
(Texto publicitário)
(Texto publicitário)
5)
Função Fática
Tem
por finalidade testar o canal.
Exemplo:
Alô?
Está me ouvindo?
|
6)
Função Metalinguística
É quando
o emissor explica um código usando o próprio código. As gramáticas
e os dicionários são exemplos de metalinguagem.
Exemplo:
Frase
é qualquer enunciado linguístico com sentido acabado.
(Para
dar a definição de frase, usamos uma frase.)
|
Literariedade:
Ocorre
quando se observa masrcas da literatura em um texto não-literário.
Exemplo: Uma propaganda, o profissional que a produz se preocupa com
a forma de fazê-la para chamar a atenção do púbilco.
Verossimilhança:
Um
texto é verossímel quando ele se parece com a realidade, exemplo: o
filme dois filhos de francisco. E um texto é inverossímel quando
ele não se parece com a realidade, exemplo: Harry Potter.
Catarsís:
Por
meio do poema o autor libera suas emoções.
segunda-feira, 24 de março de 2014
Radioatividade e meia-vida
Partícula alfa: Diminui 4 de massa e de número atômico
Partícula beta: Aumenta 1 de número atômico
O núcleo do hélio possui 2p e 2n assim como as partículas alfas.
Meia-vida:
A cada meia-vida a amostra diminui 50% de sua massa, exemplo:
40g do Na24. Sua meia-vida é 15 horas, depois de 75 horas, qual é o percentual de massa radioativa restante?
1° passo: Construa uma espécie de tabela:
40g ------- 0 horas
20g ------- 15 horas
10g ------- 30 horas
5g ------- 45 horas
2,5g ------ 60 horas
1,25g ----- 75 horas
2° passo: Faça regra de 3 pra saber a porcentagem:
100 vezes 1,25 dividido por 40 = 3,125%=x
40g ---- 100%
1,25g---- x%
Partícula beta: Aumenta 1 de número atômico
O núcleo do hélio possui 2p e 2n assim como as partículas alfas.
Meia-vida:
A cada meia-vida a amostra diminui 50% de sua massa, exemplo:
40g do Na24. Sua meia-vida é 15 horas, depois de 75 horas, qual é o percentual de massa radioativa restante?
1° passo: Construa uma espécie de tabela:
40g ------- 0 horas
20g ------- 15 horas
10g ------- 30 horas
5g ------- 45 horas
2,5g ------ 60 horas
1,25g ----- 75 horas
2° passo: Faça regra de 3 pra saber a porcentagem:
100 vezes 1,25 dividido por 40 = 3,125%=x
40g ---- 100%
1,25g---- x%
Números quânticos e distribuição eletrônica
Distribuição eletrônica
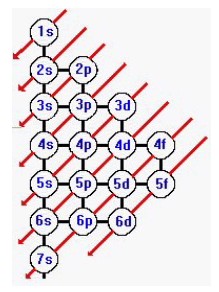
Na distribuição eletrônica usa-se o diagrama de Linus Pauling, exemplos:
Rb (Z=37): 1s2 2s2 2p6 3s2 3p6 4s2 3d10 4p6 5s1
Se o Rb fosse +1(diminui 1) ou -1(aumenta 1) se diminuiria(se fosse +1) ou aumentaria(se fosse -1) no elétron mais externo, nesse caso seria 5s1, pois ele está na 5° camada
Números Quânticos:
n: Ele indica a camada(K,L,M,N,O,P,Q) em que se encontra o elétron, ou seja, K=1, L=2, M=3 e assim sucessivamente
l: Ele indica o subnível(s,p,d,f) s=0; p=1; d=2; f=3
m: Esse número é visto dentro de cada subnível, não da pra botar aqui mas é aquele coisa dos quadrados, o subnível ''s'' só tem 1 quadrado que é o 0, ou seja , o elétron só vai poder ficar naquele quadrado, o subnível ''p'' tem 3 quadrados então na hora que você fizer a distribuição e terminar em 3p4 aí o 1° elétron vai estar no 1° quadrado, o 2° elétron no segundo quadrado, o 3° elétron no 3° quadrado e o 4° elétron volta ao primeiro quadrado(só cabe 2 elétron em um quadrado) pois só tem 3 quadrados, não coloquem o 2° elétron no 1° quadrado, só se repete quando tiver todos os quadrados com 1 elétron aí você ao 1° e depois (se tiver mais elétron) no 2° quadrado, o subnível ''d'' tem 5 quadrados e o ''f'' tem 7 quadrados.
ms: Ele indica a posição do elétron no quadrado se for o 1° elétron é -1\2 e se for o 2° elétron é +1\2, PRECISA BOTAR O + DO +1\2.
Na prova ele vai dizer se quer o número quântico do elétron mais externo ou do mais energético.
O elétron mais energético é sempre o último a ser distribuído e o mais externo é o que possui a camada mais externa(K,L,M,N,O,P,Q) o Q é a camada mais externa.

Na distribuição eletrônica usa-se o diagrama de Linus Pauling, exemplos:
Rb (Z=37): 1s2 2s2 2p6 3s2 3p6 4s2 3d10 4p6 5s1
Se o Rb fosse +1(diminui 1) ou -1(aumenta 1) se diminuiria(se fosse +1) ou aumentaria(se fosse -1) no elétron mais externo, nesse caso seria 5s1, pois ele está na 5° camada
Números Quânticos:
n: Ele indica a camada(K,L,M,N,O,P,Q) em que se encontra o elétron, ou seja, K=1, L=2, M=3 e assim sucessivamente
l: Ele indica o subnível(s,p,d,f) s=0; p=1; d=2; f=3
m: Esse número é visto dentro de cada subnível, não da pra botar aqui mas é aquele coisa dos quadrados, o subnível ''s'' só tem 1 quadrado que é o 0, ou seja , o elétron só vai poder ficar naquele quadrado, o subnível ''p'' tem 3 quadrados então na hora que você fizer a distribuição e terminar em 3p4 aí o 1° elétron vai estar no 1° quadrado, o 2° elétron no segundo quadrado, o 3° elétron no 3° quadrado e o 4° elétron volta ao primeiro quadrado(só cabe 2 elétron em um quadrado) pois só tem 3 quadrados, não coloquem o 2° elétron no 1° quadrado, só se repete quando tiver todos os quadrados com 1 elétron aí você ao 1° e depois (se tiver mais elétron) no 2° quadrado, o subnível ''d'' tem 5 quadrados e o ''f'' tem 7 quadrados.
ms: Ele indica a posição do elétron no quadrado se for o 1° elétron é -1\2 e se for o 2° elétron é +1\2, PRECISA BOTAR O + DO +1\2.
Na prova ele vai dizer se quer o número quântico do elétron mais externo ou do mais energético.
O elétron mais energético é sempre o último a ser distribuído e o mais externo é o que possui a camada mais externa(K,L,M,N,O,P,Q) o Q é a camada mais externa.
Modelo atômico
Teoria Atômica
- Demócrito: Ele era discípulo de Leucipo, Demócrito dizia que se dividíssemos uma matéria (independente de qual fosse) acharíamos o átomo, este é uma porção indivisível da matéria.
- Dalton: Também dizia que o átomo era indivisível, mas ele dizia que cada átomo tinha uma propriedade que caracterizava. Teoria de Dalton:
- Toda matéria é constituída de átomos
- Todos os átomos são as menores partículas da matéria, e átomos de diferentes elementos químicos possuem propriedades diferentes (e massa também). Os átomos são indivisíveis.
- Os átomos de mesmo elemento tem propriedades iguais e também a massa.
Seu modelo ficou conhecido como bola de bilhar.
- Thomson: Ele associou a eletricidade com os átomos(em 1874), e em 1891 ele deu o nome de elétron para a unidade de carga elétrica. Ele se diferenciava do Dalton pois já se podia achar algo do átomo, o que derrubava a ideia de que o átomo é indivisível. Com base nisso, ele criou um átomo como uma esfera uniforme, de massa uniforme de carga positiva. incrustada de elétrons. Seu modelo foi apelidado de pudim de passas.
- Rutherford: A fim de verificar se os átomos são maciços, Rutherford propôs um modelo atômico baseando-se em experimentos com radioatividade. Ele concluiu que
1. Na eletrosfera dos átomos de ouro existem espaços e algumas partículas atravessavam a lâmina passando por tais espaços.
2. As partículas alfa se desviavam porque colidiam com o núcleo dos átomos de ouro.
3. O núcleo é positivo, por isso repele as partículas alfa de carga positiva.4. O núcleo é pequeno em relação ao átomo. Um átomo é composto por um pequeno núcleo carregado positivamente e rodeado por uma grande eletrosfera, que é uma região envolta do núcleo que contém elétrons. No núcleo está concentrada a carga positiva e a maior parte da massa do átomo.
- Bohr: O modelo de Bohr representa os níveis de energia. Cada elétron possui a sua energia. É comparado às orbitas dos planetas do Sistema Solar, onde cada elétron possui a sua própria órbita e com quantidades de energia já determinadas. Bohr organizou os elétrons em camadas ou níveis de energia.
Cada camada possui um nome e deve ter um número máximo de elétron.
Existem sete camadas ou níveis de energia ao redor do núcleo: K, L, M, N, O, P, Q.
- Demócrito: Ele era discípulo de Leucipo, Demócrito dizia que se dividíssemos uma matéria (independente de qual fosse) acharíamos o átomo, este é uma porção indivisível da matéria.
- Dalton: Também dizia que o átomo era indivisível, mas ele dizia que cada átomo tinha uma propriedade que caracterizava. Teoria de Dalton:
- Toda matéria é constituída de átomos
- Todos os átomos são as menores partículas da matéria, e átomos de diferentes elementos químicos possuem propriedades diferentes (e massa também). Os átomos são indivisíveis.
- Os átomos de mesmo elemento tem propriedades iguais e também a massa.
Seu modelo ficou conhecido como bola de bilhar.
- Thomson: Ele associou a eletricidade com os átomos(em 1874), e em 1891 ele deu o nome de elétron para a unidade de carga elétrica. Ele se diferenciava do Dalton pois já se podia achar algo do átomo, o que derrubava a ideia de que o átomo é indivisível. Com base nisso, ele criou um átomo como uma esfera uniforme, de massa uniforme de carga positiva. incrustada de elétrons. Seu modelo foi apelidado de pudim de passas.
- Rutherford: A fim de verificar se os átomos são maciços, Rutherford propôs um modelo atômico baseando-se em experimentos com radioatividade. Ele concluiu que
1. Na eletrosfera dos átomos de ouro existem espaços e algumas partículas atravessavam a lâmina passando por tais espaços.
2. As partículas alfa se desviavam porque colidiam com o núcleo dos átomos de ouro.
3. O núcleo é positivo, por isso repele as partículas alfa de carga positiva.4. O núcleo é pequeno em relação ao átomo. Um átomo é composto por um pequeno núcleo carregado positivamente e rodeado por uma grande eletrosfera, que é uma região envolta do núcleo que contém elétrons. No núcleo está concentrada a carga positiva e a maior parte da massa do átomo.
- Bohr: O modelo de Bohr representa os níveis de energia. Cada elétron possui a sua energia. É comparado às orbitas dos planetas do Sistema Solar, onde cada elétron possui a sua própria órbita e com quantidades de energia já determinadas. Bohr organizou os elétrons em camadas ou níveis de energia.
Cada camada possui um nome e deve ter um número máximo de elétron.
Existem sete camadas ou níveis de energia ao redor do núcleo: K, L, M, N, O, P, Q.
Assinar:
Postagens (Atom)
