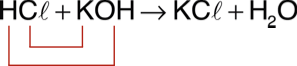 Mitose
MitoseA mitose é um processo contínuo de divisão celular que ocorre em grande parte das células durante parte do ciclo celular. Resumidamente, a mitose é o processo pelo qual uma célula diplóide dá origem a duas outras células diplóides, idênticas à célula-mãe e entre si. Isso quer dizer que uma célula com certo número de cromossomos (no caso humano, seriam 46) originaria outras duas células com a mesma quantidade de cromossomos. A mitose é dividida em fases: prófase, metáfase, anáfase e telófase. O final da mitose, com a separação do citoplasma, é chamado de citocinese.
1. Prófase (P de primeiro)
- Os cromossomos começam a ficar visíveis devido à espiralação
- O nucléolo começa a desaparecer.
- Organiza-se em torno do núcleo um conjunto de fibras (nada mais são do que microtúbulos) originadas a partir dos centrossomos, constituindo o chamado fuso de divisão (ou fuso mitótico).
- Desintegração da carioteca
Os cromossomos atingem seu grau máximo de condensação e se colocam no equador do fuso. Pelo centrômero os cromossomos estão ligados às fibras do fuso.
3. Anáfase (A de afastamento)
É a fase da separação. As fibras do fuso se encurtam em direção aos pólos levando consigo cromátides (partes) dos cromossomos, que passam a constituir um cromossomo independente cada.
4. Telófase (T de término)
Última etapa da divisão mitótica, caracterizada pelo agrupamento e descondensação dos cromossomos em extremidades opostas, reintegração da carioteca e reaparecimento do nucléolo, finalizando o processo com a citocinese (individualização do citoplasma em duas células-filhas).
5. Citocinese
A partição em duas copias é chamada de citocinese e ocorre, na célula animal, de fora para dentro, isto é, como se a célula fosse estrangulada e partida em duas (citocinese centrípeta). Há uma distribuição de organelas pelas duas células-irmãs. Perceba que a citocinese é, na verdade a divisão do citoplasma. Essa divisão pode ter início já na anáfase, dependendo da célula.
6. Intérfase
Intérfase é o período que separa duas mitoses. Tal período caracteriza-se por intensa atividade metabólica, resultante da descondensação cromossômica.
A intérfase é dividida em três períodos (G1, S e G2). O período durante o qual ocorre a duplicação do DNA é chamado de S; G1 (do inglês gap intervalo) é o período que antecede a síntese de DNA, enquanto G2 é o período que sucede a síntese de DNA e antecede a mitose.
G1: Síntese de proteínas necessárias para o aumento de tamanho da célula. Nas células que pararam de duplicar esse período torna-se predominante e se chama Gzero.
S (S de síntese): Síntese do DNA
G2: Síntese de proteína continua.
Meiose
A meiose é um processo de divisão celular em que uma célula diplóide (2n) forma quatro células haplóides (n). A meiose consiste em duas divisões celulares, acompanhadas por uma só duplicação cromossômica.
Como ocorre na divisão da mitose, também na meiose, antes de iniciar a divisão celular, a célula passa pela interfase com os períodos G1, S e G2 com os seguintes
eventos:
G1 e G2 - Síntese de proteínas e RNA
S - Síntese de DNA (autoduplicação)
A primeira etapa da meiose difere muito de uma mitose, pois ocorrem os fenômenos de pareamento e separação de cromossomos homólogos que não ocorrem na mitose. A segunda etapa da meiose é semelhante à mitose.
Meiose I
1. Prófase I –
É a etapa mais marcante da meiose. Nela ocorre o pareamento dos
cromossomos homólogos e pode acontecer um fenômeno conhecido como
crossing-over (também chamado de permuta)
Como a prófase I é longa, há uma seqüência de eventos que, para efeito de estudo, pode ser dividida nas seguintes etapas:
- Inicia-se a espiralação cromossômica. É a fase de leptóteno (leptós = fino), em que os filamentos cromossômicos são finos, pouco visíveis e já constituídos cada um por duas cromátides.
- Começa a atração e o pareamento dos cromossomos homólogos; é um pareamento ponto por ponto conhecido como sinapse (o prefixo sin provém do grego e significa união). Essa é a fase de zigóteno (zygós = par).
- A espiralação progrediu: agora, são bem visíveis as duas cromátides de cada homólogo pareado; como existem, então, quatro cromátides, o conjunto forma uma tétrade ou par bivalente. Essa é a fase de paquíteno (pakhús = espesso).
- Ocorrem quebras casuais nas cromátides e uma troca de pedaços entre as cromátides homólogas, fenômeno conhecido como crossing-over (ou permuta). Em seguida, os homólogos se afastam e evidenciam-se entre eles algumas regiões que estão ainda em contato. Essas regiões são conhecidas como quiasmas (qui corresponde à letra “x” em grego). Os quiasmas representam as regiões em que houve as trocas de pedaços. Essa fase da prófase I é o diplóteno (diplós = duplo).
- Os pares de cromátides fastam-se um pouco mais e os quiasmas parecem “escorregar” para as extremidades; a espiralação dos cromossomos aumenta. è a última fase da prófase I, conhecida por diacinese (dia = através; kinesis = movimento).
Enquanto acontecem esses eventos, os
centríolos, que vieram duplicado da interfase, migram para os pólos
opostos e organizam o fuso de divisão; os nucléolos desaparecem; a
carioteca se desfaz após o término da prófase I, prenunciando a
ocorrência da metáfase I.
2. Metáfase I: com grau máximo de condensação ou espiralização, maior que na mitose, os cromossomos estão emparelhados no equador celular.
3. Anáfase I
Com o encurtamento das fibras do fuso, os cromossomos homólogos se separam e se dirigem para pólos opostos (disjunção). Não há bipartição dos centrômeros, e as cromátides irmãs permanecem unidas. Em cada pólo, está a metade dos cromossomos da célula-mãe, ainda duplicados.
Com o encurtamento das fibras do fuso, os cromossomos homólogos se separam e se dirigem para pólos opostos (disjunção). Não há bipartição dos centrômeros, e as cromátides irmãs permanecem unidas. Em cada pólo, está a metade dos cromossomos da célula-mãe, ainda duplicados.
4. Telófase I: os cromossomos se desespiralizam, a carioteca se refaz e o citoplasma se divide, formando duas células-filhas haplóides.
Entre o final da divisão I e o início da divisão II, pode ocorrer um pequeno intervalo, a intercinese, no qual não há duplicação do DNA.
Entre o final da divisão I e o início da divisão II, pode ocorrer um pequeno intervalo, a intercinese, no qual não há duplicação do DNA.
Meiose II - Mesma coisa da Mitose